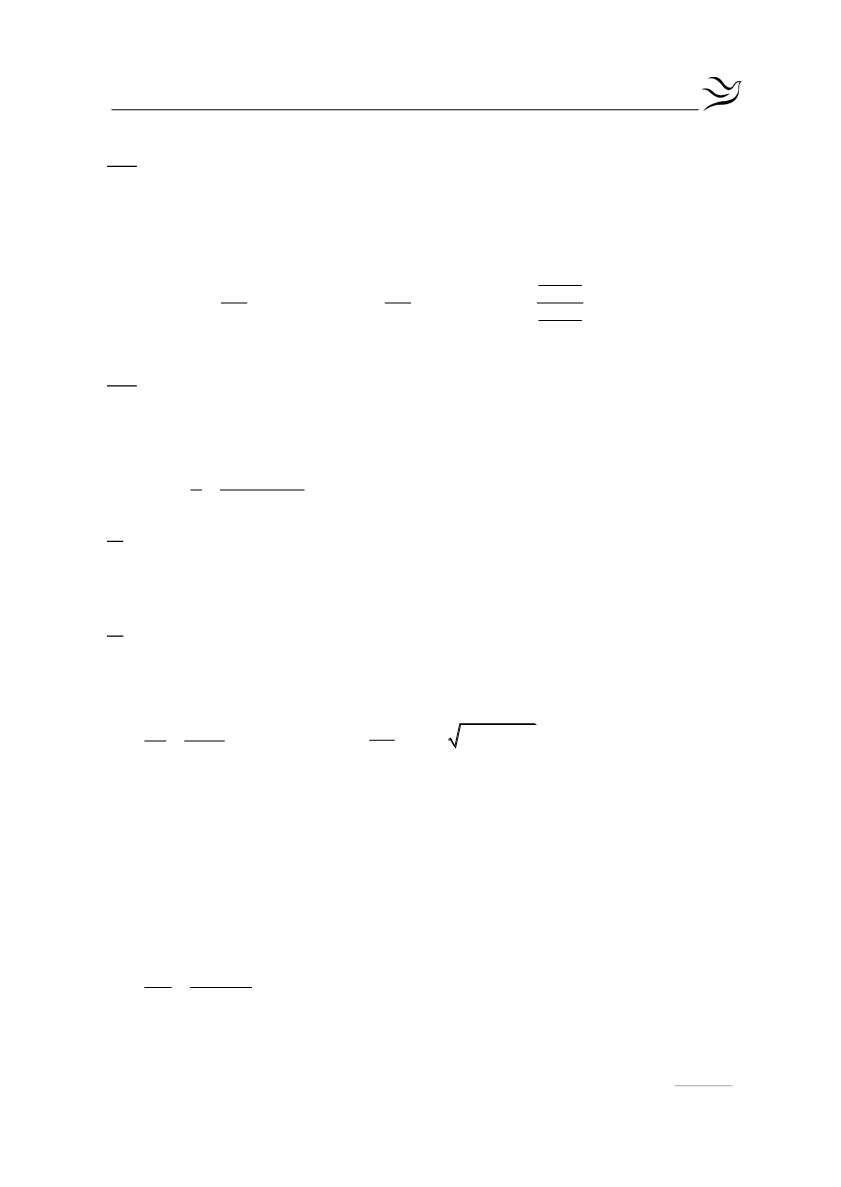
47
Χημεία Θετικής Κατεύθυνσης – Εκδόσεις ΜΠΑΧΑΡΑΚΗ
4.2.α.
τα mol του NaOH στα 25 ml του Δ
2
:
΄
2 ΄2
n C V 0,2 0,025 0,005mol
mol|
HA + NaOH
NaA + H
2
O
Αρχ.
0,01 0,005
Αντ./παρ.
0,005
0,005 0,005
Τελ.
0,005
0,005
Προκύπτει ρυθμιστικό διάλυμα ΗΑ
ΝaA, Από εξίσωση Henderson-Hasselbalch:
β
β
5
a
a
a
a
οξ
οξ
0,005
0,075
0,005
0,075
C
C
pH pK log
pK pH log
pK 5 log
5 K 10
C
C
β.
mol| HA + NaOH
NaA + H
2
O
Αρχ.
0,01 0,01
Αντ./παρ.
0,01
0,01 0,01
Τελ.
0,01
άλατος
n 0,01
C
0,1 M
v 0,05 0,05
Μ| ΝaA
Na
+
+ A
0,1 0,1 0,1
Το Na
+
είναι συζυγές οξύ της ισχυρής βάσης ΝaΟΗ, άρα δεν αντιδρά με το νερό.
Το A
-
είναι συζυγής βάση του ασθενούς οξέος ΗΑ, άρα αντιδρά με το νερό.
Μ|
A
+ Η
2
Ο
⇄
ΗA + ΟΗ
Αρχ.
0,1
Αντ./Παρ.
y
y
y
ΙΙ
0,1
y
y
y
14
9
w
b
5
a
K 10
K
10
K 10
, όμως
2
9
1
5
b
y
K
y 10 10 10 M
0,1
.
5
pOH log OH log10 5
, άρα
pH 14 pOH 14 5 9
.
4.3
(M)
HB +
H
2
O
⇄
B
+
H
3
O
+
Αρχ
0,1
Ιοντ./Παρ. ―ω
ω
ω
ΙΙ
0,1―ω
ω
ω
2,5
3
pH 2,5 [H O ] 10 M ω
. Υπολογίζουμε την Κα του ΗΒ:
2
2,5 2
4
a
1
ω (10 )
Κ
10
0,1 10
΄
Συγκρίνοντας τις Κa των δύο οξέων (ίδια θερμοκρασία, κοινός διαλύτης),
διαπιστώνουμε ότι το ΗΒ είναι ισχυρότερο.









