Εκδόσεις ΜΠΑΧΑΡΑΚΗ – Χημεία Θετικής Κατεύθυνσης
16
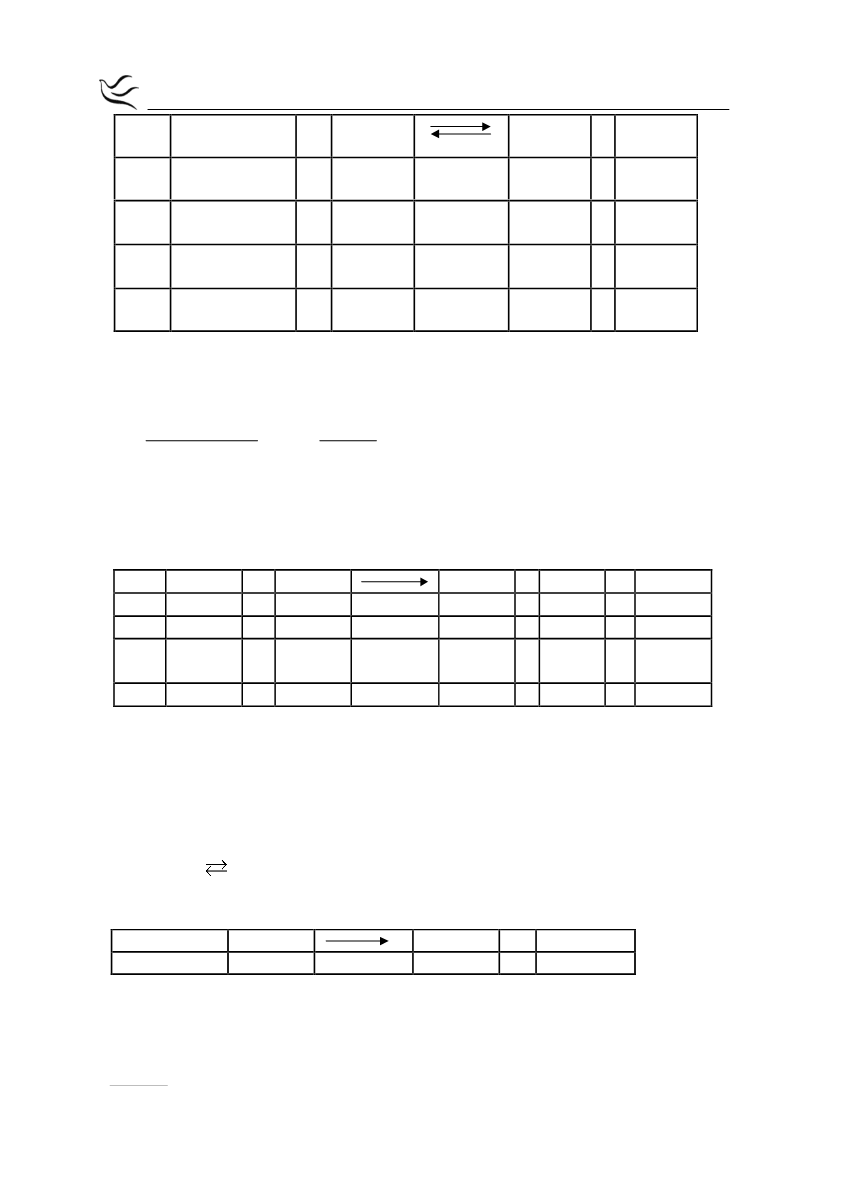
(Μ)
RNH
3
+
+ Η
2
Ο
RNH
2
+ Η
3
Ο
+
Αρχ.
0,1 M
- - -
- - -
- - -
Ι οντ
.
10
-5
M
- - -
- - -
- - -
Παρ
.
- - -
- - -
10
-5
M 10
-5
M
Τελ. ( 0,1-10
-5
) M
- - -
10
-5
M 10
-5
M
Τελικά:
[RNH
2
] = [Η
3
Ο
+
] = 10
-5
M,
[RNH
3
+
] = 0,1 - 10
-5
0,1 M
25
2
3
9
α
α
3
RNH H O
10
K
K
10
0,1
RNH
β). (i)
Στο 1L του διαλύματος υπάρχουν n
RNH3Cl
= 0,1∙1 = 0,1 mol.
Προσθέτουμε 8g NaOH, δηλαδή:
n
NaOH
= 8/40 = 0,2 mol
Πραγματοποιείται αντίδραση μεταξύ των ηλεκτρολυτών:
RNH
3
Cl
+ NaΟH
RNH
2
+ Η
2
Ο + NaCl
Αρχ. 0,1 mol
0,2 mol
- - -
- - -
Aντ. 0,1 mol
0,1 mol
- - -
- - -
Παρ
.
- - -
- - -
0,1 mol
0,1 mol
Τελ.
- - -
0,1 mol
0,1 mol
0,1 mol
Το νέο διάλυμα έχει:
C
RNH2
= 0,1 M, C
NaOH
= 0,1 M, C
NaCl
= 0,1 M
+
-
+
-
+
-
2
2
3
NaOH Na + OH
NaCl Na + Cl
RNH + Η Ο RNH + OH
(ii)
Πρακτικά το pH καθορίζεται από την πλήρη διάσταση της ισχυρής
βάσης NaOH:
NaOH
Na
+
+ OH
-
Ι οντ./ Παρ.
0,1 M
0,1 M
0,1 M
Άρα: [OH
-
] = 0,1 Μ = 10
-1
Μ
pOH = 1
και
pH = 13.









