113
Χημεία Θετικής Κατεύθυνσης – Εκδόσεις ΜΠΑΧΑΡΑΚΗ
Διαθέτουμε τα υδατικά διαλύματα:
Διάλυμα Α: CH
3
COOH 0,2 M (Κ
a
=10
-5
)
Διάλυμα Β: NaOH 0,2 M
Διάλυμα Γ: HCl 0,2 M
Δ1.
Nα υπολογιστεί το pH
του διαλύματος, που προκύπτει με ανάμειξη 50
mL διαλύματος A με 50 mL διαλύματος Β.
(Μονάδες 4)
Δ2.
50 mL διαλύματος Α αναμειγνύονται με 100 mL διαλύματος B και το
διάλυμα που προκύπτει αραιώνεται με Η
2
Ο μέχρι όγκου 1 L, οπότε προκύπτει
διάλυμα Δ. Να υπολογιστεί το pH
του διαλύματος Δ.
(Μονάδες 5)
Δ3.
Προσθέτουμε 0,15 mol στερεού NaOH σε διάλυμα, που προκύπτει με
ανάμειξη 500 mL διαλύματος A με 500 mL διαλύματος Γ, οπότε προκύπτει
διάλυμα Ε. Να υπολογιστεί το pH
του διαλύματος Ε.
(Μονάδες 8)
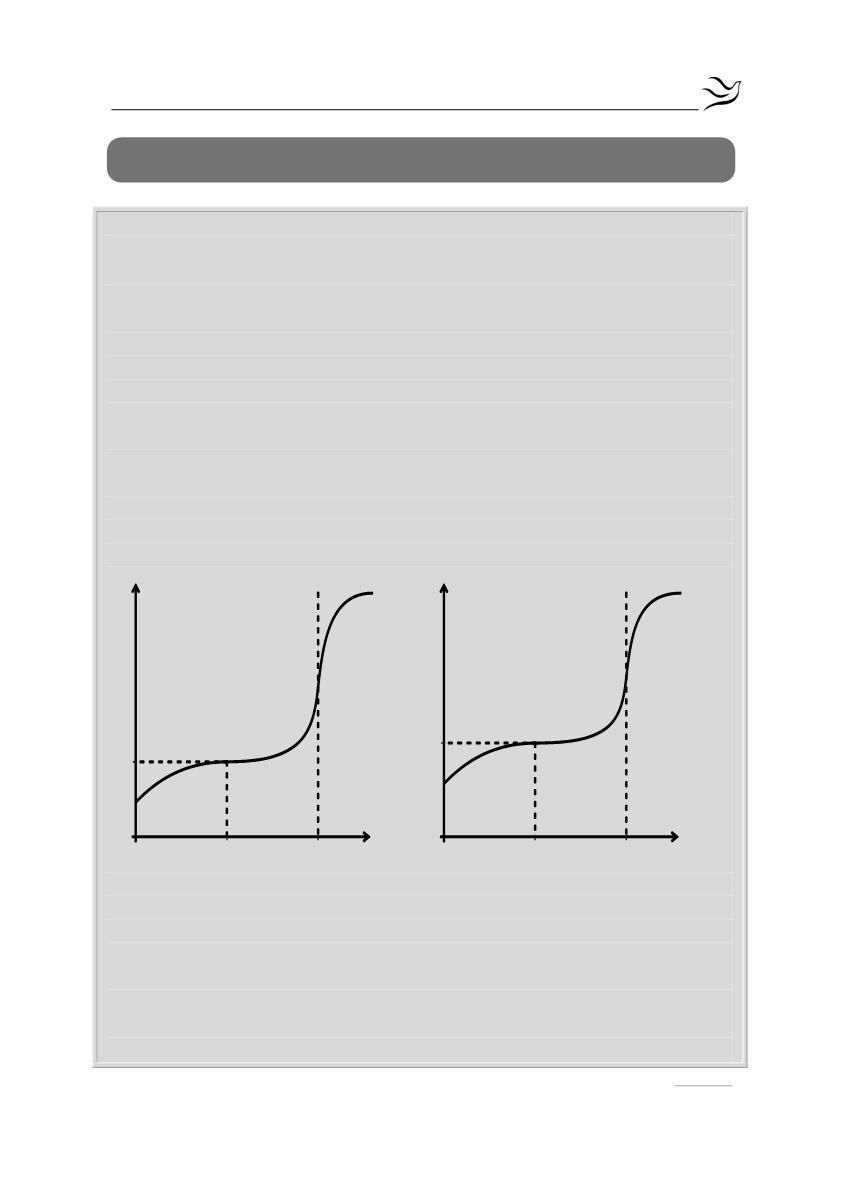
Δ4.
Οι καμπύλες (1) και (2) παριστάνουν τις καμπύλες ογκομέτρησης ίσων
όγκων διαλύματος CH
3
COOH και ενός διαλύματος οξέος ΗΒ με πρότυπο
διάλυμα NaOH 0,2 Μ.
α.
Ποια καμπύλη αντιστοιχεί στο CH
3
COOH και ποια στο ΗΒ; (μονάδες 2)
β.
Να υπολογιστεί η τιμή Κ
a
του οξέος ΗΒ.
(μονάδες 3)
γ.
Να υπολογιστεί το pH στο Ισοδύναμο Σημείο κατά την ογκομέτρηση
του ΗΒ.
(μονάδες 3)
(Μονάδες 8)
Δίνεται ότι:
Όλα τα διαλύματα βρίσκονται σε θερμοκρασία θ=25 °C
K
w
=10
−14
pH
4
10
20 V(mL) NaOH
Καμπύλη 1
0
pH
5
0
Καμπύλη 2
10
20 V(mL) NaOH
ΘΕMA Δ
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ 2013









