7
Χημεία Θετικής Κατεύθυνσης – Εκδόσεις ΜΠΑΧΑΡΑΚΗ
1
. Δίνονται τα στοιχεία H, O, Cl, που έχουν ατομικούς αριθμούς 1, 8, 17,
αντίστοιχα.
2
.
α
. Να γράψετε τις ηλεκτρονιακές δομές (στιβάδες, υποστιβάδες) των
παραπάνω στοιχείων στη θεμελιώδη κατάσταση και να αναφέρετε ονομαστικά
τις αρχές και τον κανόνα της ηλεκτρονιακής δόμησης.
(Μονάδες 6)
β
. Να γράψετετε τον ηλεκτρονιακό τύπο κατά Lewis του χλωριώδους
οξέος (HClO
2
).
(Μονάδες 5)
3
. Υδατικό διάλυμα μεθανικού οξέος (HCOOH) αραιώνεται με νερό σε σταθερή
θερμοκρασία. Πώς μεταβάλλεται ο βαθμός ιοντισμού του HCOOH με την
αραίωση
Να δικαιολογήσετε την απάντηση σας (θεωρείται ότι ισχύουν οι
προσεγγιστικοί τύποι).
(Μονάδες 5)
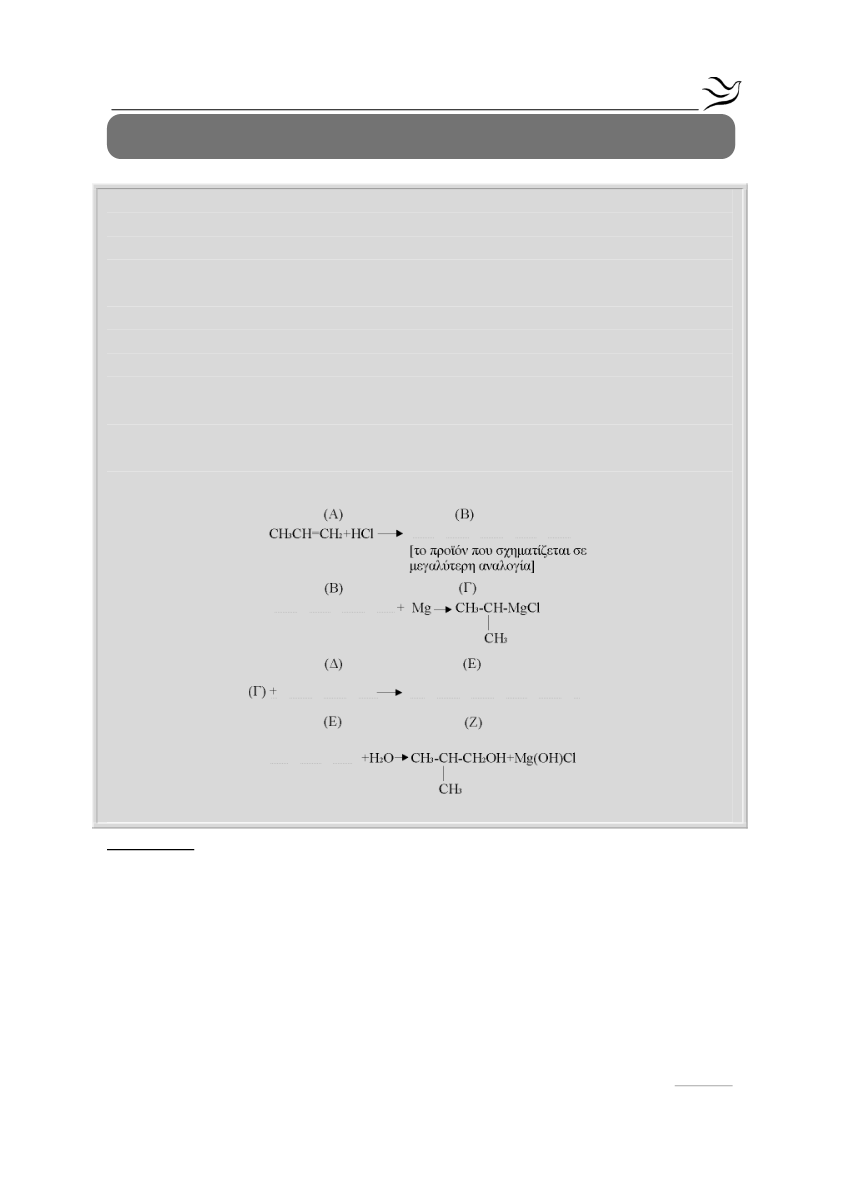
4
. Να μεταφέρετε στο τετράδιό σας σωστά συμπληρωμένες τις παρακάτω
χημικές εξισώσεις
(Μονάδες 9)
Απάντηση:
1
.
α
1
H : 1s
1
8
O : 1s
2
, 2s
2
, 2p
4
17
Cl : 1s
2
, 2s
2
,2p
6
, 3s
2
, 3p
5
Οι παραπάνω ηλεκτρονιακές δομές πραγματοποιούνται με βάση τα εξής
1)
Αρχή ελάχιστης ενέργειας.
2)
Απαγορευτική αρχή του Pauli.
3)
Κανόνας του Hund.
β.
••
••
••
••
••
••
Η Ο Cl
O:
ΖHTHMA 2ο
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ 2000









