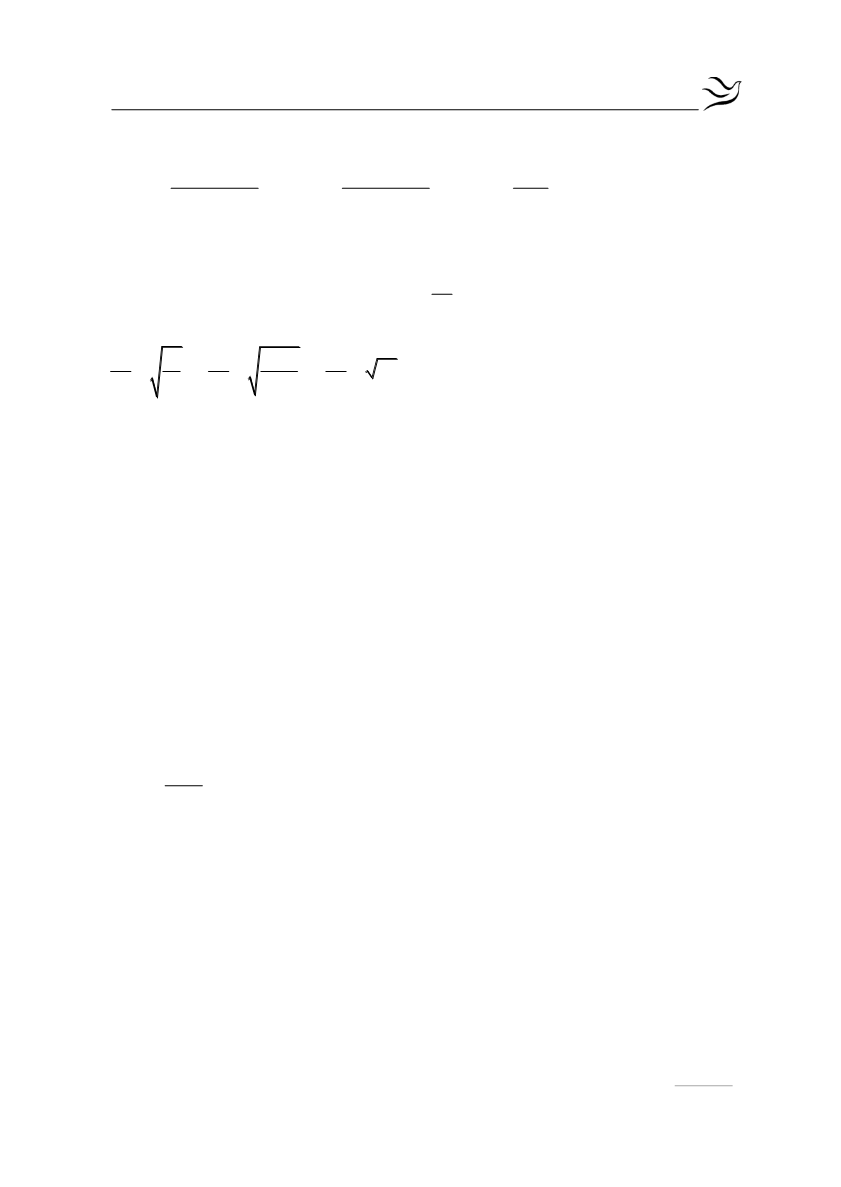
163
Χημεία Θετικής Κατεύθυνσης – Εκδόσεις ΜΠΑΧΑΡΑΚΗ
Το pH του διαλύματος Δ
1
είναι ίσο με pH=11. Άρα pOH=3.Συνεπώς [ΟΗ
-
]=10
-3
Μ
Δηλαδή x=10
-3
.
3
3
6
1
4
4
b(NH )
3
3
3
5
3
b(NH )
[NH ][OH ]
[NH ][OH ]
10
K
[NH ]
[NH ]
[NH ] 10 0,1M
[NH ]
K
10
Έστω C
2
η συγκέντρωση της ΝΗ
3
στο διάλυμα Δ
2
:
Πρόκειται για αραίωση διαλύματος, οπότε ισχύει:
1
1 1
2 2
1 1
2
1
2
2
C
C V C V C V C 10 V C
C 0,01M
10
Έτσι για τον λόγο τον βαθμών ιοντισμού προκύπτει:
2
1
2
2
1
2
1
1
α c α
α 0,1
10
α c α 0,01 α
β.
Υπολογίζουμε τον αριθμό mol των δύο ηλεκτρολυτών (ΝΗ
3
και ΗCl) στα
αρχικά διαλύματα:
3
3
NH
NH
n 0,1 0,1 n 0,01
HCl
HCl
n 0,1 0,1 n 0,01
Υπολογίζουμε τον αριθμό mol όλων των ουσιών στο τελικό διάλυμα μετά από
την αντίδραση:
3
4
(mol)
NH
HCl
NH Cl
Αρχ.
0,01
0,01
Aντ. / παρ.
0,01
0,01
0,01
Τελικά
0,01
Υπολογίζουμε την νέα συγκέντρωση του άλατος στον τελικό όγκο 1L:
4
4
NH Cl
NH Cl
0,01
c
c
0,01M
1
4
4
(M)
NH Cl
NH
Cl
Αρχ.
0,01
Aντ. / παρ.
0,01
0,01
0,01
Τελικά
0,01
0,01









