Εκδόσεις ΜΠΑΧΑΡΑΚΗ–
Χημεία Ομάδας Προσανατολισμού Θετικών Σπουδών
124
Δ1.
Το CH
4
είναι το κύριο συστατικό του φυσικού αερίου και έχει πολλές
χρήσεις. Ένας τρόπος σύνθεσής του περιγράφεται με την ακόλουθη αντίδραση:
2
4
C(s) + 2H (g)
CH (g)
Σε κλειστό δοχείο όγκου 10 L εισάγονται ισομοριακές ποσότητες C(s) και H
2
(g),
οπότε σε θερμοκρασία Τ αποκαθίσταται η παραπάνω ισορροπία με σταθερά
Κ
c
=0,1.
Η απόδοση της αντίδρασης είναι 50%. Να υπολογίσετε τα αρχικά mol των
αντιδρώντων που εισήχθησαν στο δοχείο.
Μονάδες 6
Δ2.
Μία από τις χρήσεις του CH
4
(g) είναι η παρασκευή του τοξικού αερίου
υδροκυανίου (ΗCN), το οποίο συντίθεται σύμφωνα με την αντίδραση:
4
3
2
2
_CH (g) _NH (g) + _O (g)
_HCN(g) + _H O(g)
α.
Να μεταφέρετε τη χημική εξίσωση στο τετράδιό σας συμπληρώνοντας
τους συντελεστές. (μονάδες 3)
β.
Ποσότητα αερίου HCN απομονώνεται και χρησιμοποιείται για την
παρασκευή ισομοριακής ποσότητας μεθανικού νατρίου (HCOONa). Το HCOONa
διαλύεται σε νερό και παρασκευάζεται διάλυμα Δ1 όγκου 2L. Από το διάλυμα
Δ1 λαμβάνεται ποσότητα 20 mL η οποία ογκομετρείται με πρότυπο διάλυμα
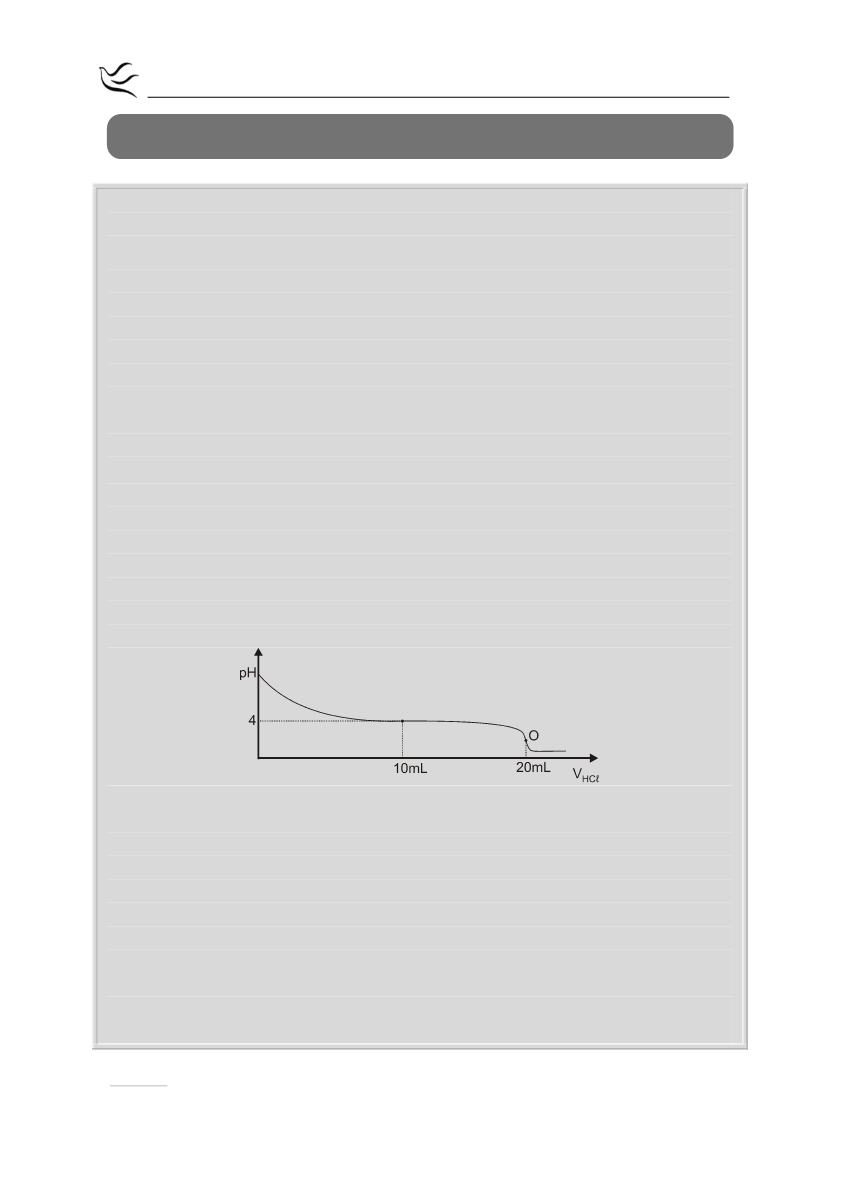
HCl(aq) συγκέντρωσης 0,2 Μ. Η καμπύλη ογκομέτρησης δίνεται παρακάτω:
Το σημείο
Ο
είναι το ισοδύναμο σημείο της ογκομέτρησης.
i)
Να προσδιορίσετε τη συγκέντρωση του ογκομετρούμενου διαλύματος.
(μονάδες 2)
ii)
Με βάση την καμπύλη ογκομέτρησης να αποδείξετε ότι η Κa του ΗCOOH
είναι 10
–4
. (μονάδες 3)
iii)
Να υπολογίσετε το pH στο ισοδύναμο σημείο. (μονάδες 2)
iv)
Στον ακόλουθο πίνακα δίνονται τέσσερις πιθανοί δείκτες που μπορούν να
χρησιμοποιηθούν για τον προσδιορισμό του τελικού σημείου της
ογκομέτρησης.
Να επιλέξετε τον καταλληλότερο δείκτη (μονάδα 1) και να αιτιολογήσετε την
απάντησή σας. (μονάδες 2)
ΘΕΜΑ Δ
ΠΑΝΕΛΛΑΔΙΚΕΣ ΕΞΕΤΑΣΕΙΣ 2018









